CRECIMIENTO MICROBIANO
Dr. Mic. Emiliano Salvucci
Si te fue útil puedes pagarme un café..
https://mpago.la/2oe8f7r… o una cerveza
https://mpago.la/17yLQEK1. CRECIMIENTO MICROBIANO. Definición.
Entendemos por crecimiento microbiano el aumento del número de microorganismos a lo largo del tiempo. Por tanto, no nos referimos al crecimiento de un único microorganismo (ciclo celular), sino al demográfico. El crecimiento de una población es el aumento del número de células como consecuencia de un crecimiento individual y posterior división

1.1. CICLO CELULAR
Las células aisladas cultivadas en un volumen finito de medio de cultivo apropiado van utilizando los nutrientes que tienen disponibles, sintetizando sus propios componentes celulares y dividiéndose en cuanto duplican su masa y su material genético. El tiempo que tarda una célula en cumplir ese proceso se denomina tiempo de generación (τ) y puede variar desde unos 20 minutos en condiciones óptimas hasta varios meses en condiciones ambientales. Cada vez que transcurre un tiempo de generación, el número de células se duplica, siguiendo, por tanto, un incremento exponencial.
2. CINÉTICA DE CRECIMIENTO DE UN CULTIVO DISCONTINUO. PARÁMETROS.
En este apartado vamos a revisar el estudio de la cinética del crecimiento de microorganismos que crecen aislados que no forman ningún tipo de estructura. Esta es la forma de crecimiento de las levaduras (hongo unicelular) y bacterias.
Es importante conocer la cinética de crecimiento de los cultivos microbianos para predecir cómo va a evolucionar un cultivo, cómo va a ir consumiéndose el substrato y cómo se van a ir acumulando los productos del cultivo. Conociendo estos factores es posible iniciar el cultivo a mayores escalas.
2.1 TRATAMIENTO DEL CRECIMIENTO COMO PROGRESIÓN GEOMÉTRICA
Las bacterias crecen siguiendo una progresión geométrica en la que el número de individuos se duplica al cabo de un tiempo determinado denominado tiempo de generación(τ). De esta forma, podemos calcular el número de bacterias (N) al cabo de un número de generaciones (n) usando la ecuación siguiente:
N = N0 2g (ecuación 1)
siendo N0 el número de células en el momento actual. El número de generaciones se puede calcular de la siguiente forma:
g = t / τ (ecuación 2)
donde t es el tiempo transcurrido.
Por consiguiente, combinando las ecuaciones 1 y 2:
N = N0 2t/τ (ecuación 3)
Las ecuaciones exponenciales son muy difíciles de manejar gráficamente, por ello es mejor transformarlas en otras más simples. Para transformar una ecuación exponencial en una recta, tomamos logaritmos en los dos términos y resulta:
lnN = lnN0 + (t/τ) ln2 (ecuación 4) ó
logN = log N0 + (t/τ) log2
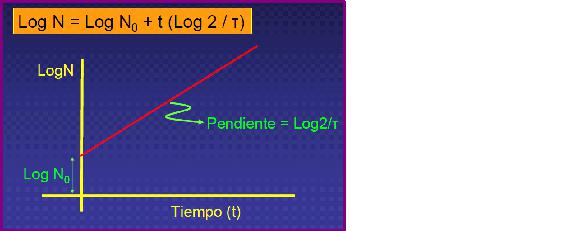
El logaritmo del número de células crece linealmente con el tiempo a razón de una constante igual a ln2/τ. Si el tiempo de generación τ es muy grande, el crecimiento tendrá poca pendiente (será lento) y si τ es pequeño el crecimiento será rápido. En un crecimiento equilibrado, todos los parámetros de crecimiento (número de células, biomasa de cultivo, acumulación de metabolitos primarios, proteínas, ácidos nucleicos etc.) evolucionan en paralelo. Por tanto, en la ecuación anterior N puede representar cualquiera de estos factores.
2.2. TRATAMIENTO DEL CRECIMIENTO EN FUNCIÓN DE LA TASA DE CRECIMIENTO μ
Otra forma de representar la cinética es considerando el incremento en el número de células (dN) en un intervalo corto de tiempo (dt). En este caso, la ecuación que describe la cinética es la siguiente:
dN/dt = μN (ecuación 5)
esto es: el incremento del número de células (dN) por unidad de tiempo (dt) es proporcional al número de células presentes en el cultivo (N). A la constante de proporcionalidad (μ) se le denomina tasa de crecimiento.
Integrando la ecuación anterior durante el tiempo de cultivo, se transforma en la siguiente función exponencial:
N = N0 eμt (ecuación 6)
la transformación de esta ecuación en una recta (tomando logaritmos) rinde lo siguiente:
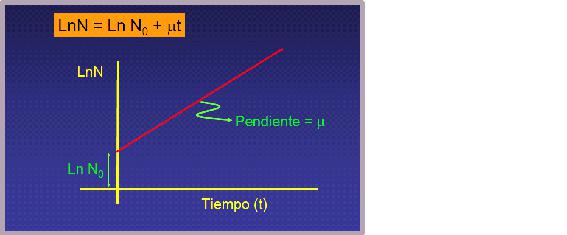
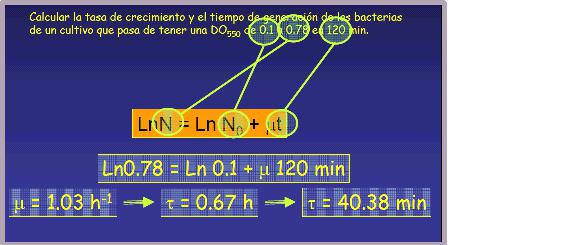
lnN = lnN0 + μt (ecuación 7)
El incremento del logaritmo del número de células aumenta linealmente con el tiempo siendo la constante de proporcionalidad μ.
Comparando esta ecuación (7) con la similar presentada más arriba (4), podemos concluir que μ = ln2/τ y, por consiguiente, que τ = ln2/μ. Es decir, que hay una correlación inversa entre el valor de la tasa de crecimiento (μ) y el tiempo de generación (τ).
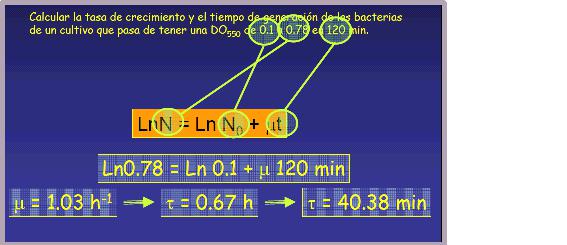
Estas ecuaciones nos permiten relacionar los parámetros de crecimiento y predecir cuál será el número de células, masa celular, etc. después de un cierto tiempo de cultivo (t) si conocemos μ; o bien, poder calcular la tasa de crecimiento μ a partir de medidas experimentales del incremento en el número de células, biomasa, etc. como se observa en el siguiente ejemplo:
- RENDIMIENTO (Ys) DE LOS CULTIVOS.
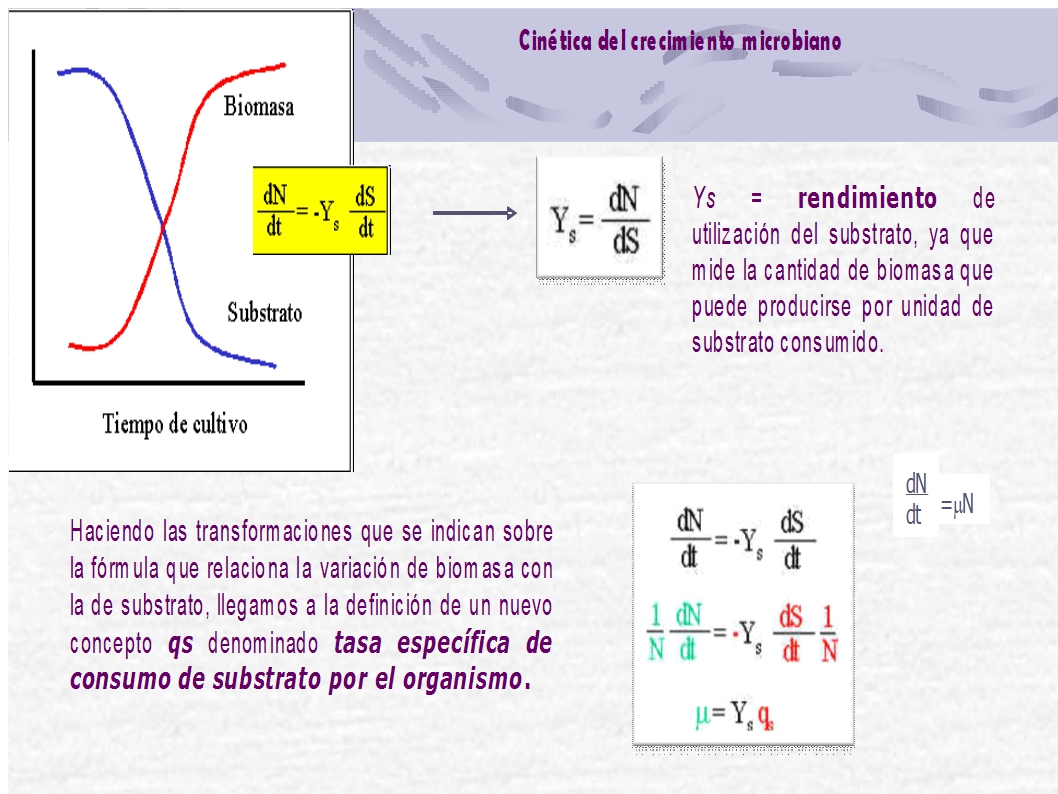
El gráfico siguiente representa la variación de la biomasa (o número de células, etc.) de un cultivo a lo largo del tiempo. En este cultivo, se va consumiendo un substrato cuya concentración decrece de forma proporcional al crecimiento de la biomasa.
A la tasa específica de consumo de substrato (qs) la podemos considerar la “velocidad” con la que el organismo consume el substrato. Evidentemente, cuanto mayor sea la tasa de consumo mayor será la tasa de crecimiento (μ).
qs = Ys/μ (ecuación 8)
Asimismo, cuanto mayor sea el rendimiento del substrato consumido, también mayor será la tasa de crecimiento. Sin embargo, hay una cierta compensación entre la tasa de consumo del substrato y el rendimiento de forma que los microorganismos que tienen altas tasas de consumo de substrato tienen rendimiento más bajos (o cuando se dan las condiciones para una alta tasa, el rendimiento disminuye). A esta relación inversa se le conoce con el nombre de efecto Pasteur.
Por último, nos falta relacionar la velocidad de crecimiento (μ) con la concentración de substrato (S). En condiciones de substrato abundante, la concentración de este no afecta al valor de μ; pero cuando el substrato se hace limitante, sí existe ese efecto. La expresión matemática que relaciona ambos parámetros se conoce con el nombre de ecuación de Monod y es la siguiente:
μ = μmax [S/(Ks+S)] (ecuación 9)
En esta ecuación la tasa de crecimiento (μ) depende de la máxima que puede alcanzar el microorganismo (μmax), de la concentración de substrato (S) y de un valor constante, Ks, que representa la concentración de substrato a la que se alcanza una tasa de crecimiento igual a la mitad de la máxima. La ecuación de Monod tendrá mucha importancia al tratar de cultivos continuos. Para que se cumpla esta ecuación el rendimiento debe ser independiente de la concentración de substrato. En la práctica, los valores de Ks suelen ser muy bajos, lo que indica que los microorganismos crecen con tasas (μ) muy próximas a las máximas (μmax) a concentraciones de substrato bajas y sólo cuando estas son extremadamente bajas, la velocidad de crecimiento se reduce. Esto es debido a que los sistemas de transporte de nutrientes suelen tener valores de Km considerablemente reducidos (La Km indica la concentración de substrato a la que la velocidad de transporte es la mitad de la máxima).
- CRECIMIENTO MICROBIANO EN MEDIO LÍQUIDO
Si la bacteria crece en un medio líquido, en la mayoría de los casos las células que se producen en cada división forman una suspensión de células libres.
En un cultivo discontinuo de bacterias en medio líquido, se pueden diferenciar cuatro fases en la evolución de los parámetros que miden el crecimiento microbiano (Fig. 2):
1.- Fase lag o de adaptación durante la que los microorganismos adaptan su metabolismo a las nuevas condiciones ambientales (abundancia de nutrientes y condiciones de cultivo). En esta fase no hay incremento en el número de células, pero hay gran actividad metabólica, aumento en el tamaño individual de las células, en el contenido proteico, ADN y peso seco de las células.
2.- Fase exponencial o logarítmica: en ella la velocidad de crecimiento es máxima y el tiempo de generación es mínimo. Durante esta fase las bacterias consumen a velocidad máxima los nutrientes del medio. La evolución del número de células durante esta fase se explica con los modelos matemáticos descritos anteriormente.
Si un cultivo que está creciendo en fase exponencial es inoculado al mismo medio de cultivo bajo las mismas condiciones de crecimiento, no se observa fase de latencia y el crecimiento exponencial sigue a la misma velocidad.
3.- Fase estacionaria: en ella no se incrementa el número de bacterias (ni la masa u otros parámetros del cultivo). Las células en fase estacionaria desarrollan un metabolismo diferente al de la fase exponencial y durante ella se produce una acumulación y liberación de metabolitos secundarios que pueden tener importancia industrial.
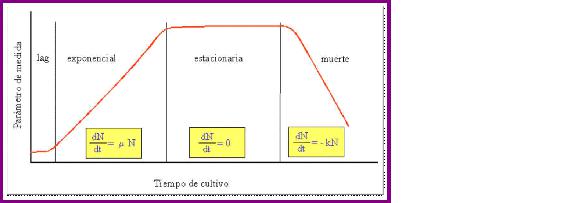
Fig. 2. Fases del crecimiento microbiano
Los microorganismos entran en fase estacionaria porque se agota algún nutriente esencial del medio o porque los productos de desecho que han liberado durante la fase exponencial hacen que el medio sea inhóspito para el crecimiento microbiano. La fase estacionaria tiene gran importancia porque probablemente represente con mayor fidelidad el estado metabólico real de los microorganismos en los ambientes naturales.
4.- Fase de muerte: Si la incubación continúa después de que una población microbiana alcanza la fase estacionaria, las células pueden seguir vivas y continuar metabolizando, pero va a comenzar una disminución progresiva en el número de células viables y cuando esto ocurre se dice que la población ha entrado en fase de muerte.
- CRECIMIENTO MICROBIANO EN MEDIO SÓLIDO
Las fases, parámetros y cinética de crecimiento discutidas para el caso de los cultivos líquidos se presentan también en cultivos sólidos. La cinética de crecimiento, en este caso, se puede estudiar siguiendo la evolución del número de células viables por unidad de superficie o por unidad de masa.
Cuando una célula aislada e inmóvil comienza a crecer sobre un substrato sólido, el resultado del crecimiento al cabo del tiempo es una colonia. Por consiguiente, se denomina unidad formadora de colonia (UFC) a una célula bacteriana viva y aislada que si se encuentra en condiciones de substrato y ambientales adecuadas da lugar a la producción de una colonia en un breve lapso de tiempo. Si el número inicial de bacterias por unidad de superficie es muy alto, la confluencia de las colonias da lugar a lo que se llama un césped cuando se realizan los cultivos en placas de laboratorio.
En el caso de microorganismos móviles (deslizantes) o en el de los hongos filamentosos que tienen un crecimiento trófico no se producen colonias aisladas sino formaciones más difusas o miceliares.
- CONCEPTO DE MUERTE DE UN MICROORGANISMO
Desde el punto de vista microbiológico, un microorganismo muere cuando pierde de orma irreversible la capacidad de dividirse. Como consecuencia de esta pérdida, no se
produce aumento en el número de microorganismos y, por tanto, no hay crecimiento. Sin embargo, un microorganismo puede estar muerto desde el punto de vista microbiológico y continuar desarrollando una actividad metabólica que se traduzca, por ejemplo, en liberación de toxinas. Por otra parte, hay que considerar que la capacidad de multiplicación (crecimiento) de un microorganismo puede verse transitoriamente afectada por lesiones o por las condiciones físicas o químicas del entorno. En estos casos, podríamos considerar como muertos microorganismos que pueden reanudar su crecimiento si las condiciones son de nuevo favorables.
- MEDIDA DEL CRECIMIENTO Y ENUMERACIÓN DE MICROORGANISMOS
Existen diferentes sistemas para detectar y medir el crecimiento de microorganismos.
Los métodos mas utilizados son el recuento de viables en placa y el método turbidimétrico:
1.- Recuento de viables: Consiste en la dilución de una muestra (con solución salina estéril, buffer fosfato, agua peptona) hasta que las bacterias se diluyan lo suficiente como para contar con precisión. Se siembra un volumen determinado de cultivo o muestra sobre el medio de cultivo sólido adecuado para estimar el número de viables contando el número de colonias que se forman puesto que cada una de estas deriva de una célula aislada. Las placas de final de la serie debe tienen entre 25 y 250 colonias (o entre 30 y 300 colonias). Menos de 25 las colonias no son aceptables por razones estadísticas, y más de 250 colonias en una placa es probable que produzcan colonias muy cerca unos de otros para ser distinguidos como distintas unidades formadoras de colonias (UFC).
En ciertas ocasiones en las que la densidad de microorganismos es demasiado baja, éstos se pueden recolectar por filtración a través de una membrana (de 0.2 μm de tamaño de poro) y posterior colocación de la membrana en un medio de cultivo adecuado para que se formen las colonias.
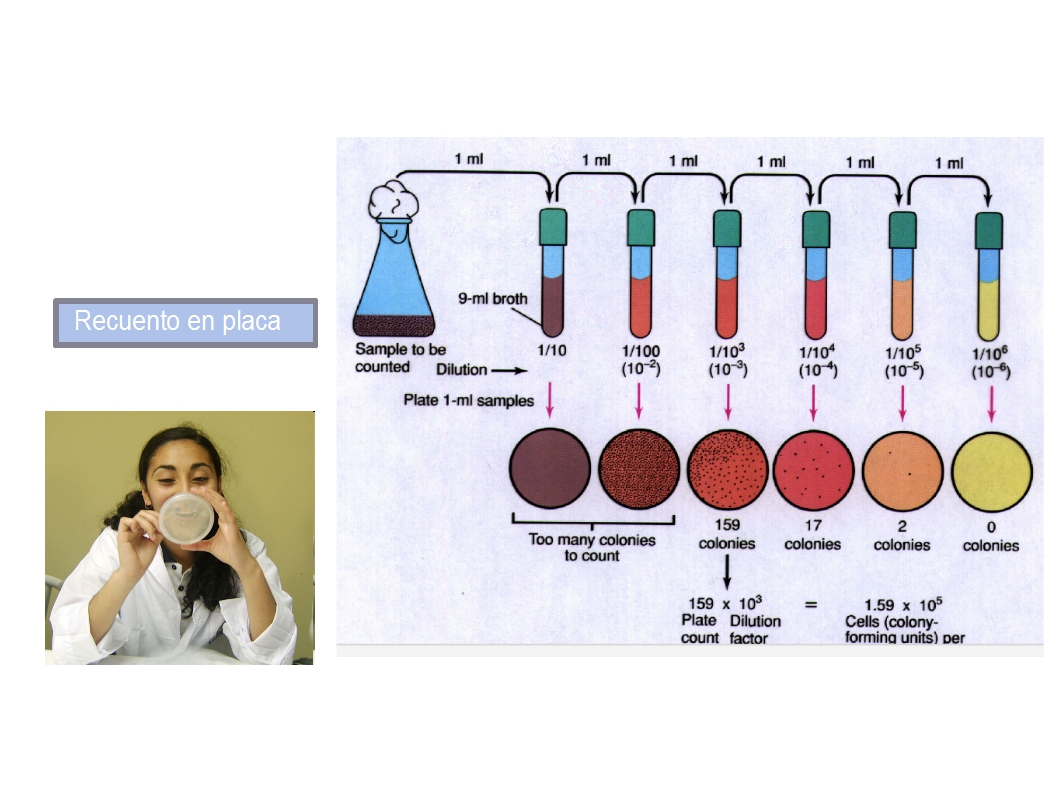
Las relaciones de dilución, pueden presentarse ya sea con dos puntos (:) o barras (/). Una barra indica la proporción de una parte a un conjunto, por ejemplo, 1 / 2 significa 1 de 2 partes, con de un total de 2 partes. Dos puntos indica la proporción de 1 parte a 2 partes, con un total de 3 partes. Así, 1 / 2 es igual a 1:1, pero 1:2 es igual a 1 / 3.
2.- Método turbidimétrico: el sistema se basa en que las células en suspensión dispersan la luz causando la turbidez del cultivo. La turbidez depende de la masa en suspensión y, por tanto, midiendo esta se puede estimar aquella. Este es el parámetro de medida más fácil de usar en los cultivos de laboratorio. La densidad de células debe ser del orden de 105 por ml. Esta metodología se basa en la ley de Lambert-Beer.
Ley de Lambert-Beer:
Hay una relación exponencial entre la transmisión de luz a través de una sustancia y la concentración de la sustancia, así como también entre la transmisión y la longitud del cuerpo que la luz atraviesa. Si conocemos Io y I1, la concentración de la sustancia puede ser deducida a partir de la cantidad de luz transmitida.
La intensidad de la energía radiante transmitida I1 es menor a la intensidad inicial Io debido precisamente a que la solución fue capaz de absorber cierta cantidad de energía radiante.
La linealidad de la ley de Beer-Lambert se ve limitada por factores químicos e instrumental:
* Desviaciones en los coeficientes de absorción a altas concentraciones (> 0,01 M), debido a las interacciones electrostáticas entre las moléculas en las proximidades.
* Dispersión de la luz por partículas en la muestra.
* Fluoresecencia o fosforescencia de la muestra.
* Los cambios en el índice de refracción a alta concentración del analito.
El lector de Microplaca nos permite realizar el seguimiento del crecimiento microbiano midiendo la turbidez del cultivo en los pocillos de una microplaca (200 ml de cultivo). La lectura de la densidad óptica del cultivo se realiza automáticamente en los tiempos indicados por el operador, durante todo el tiempo de incubación sin necesidad de tomar muestras a los tiempos correspondientes.
Obtenemos curvas de crecimiento como se observa en la figura siguiente:
Crecimiento de Listeria innocua 7 en caldo cerebro corazón, a 37 ºC en diferentes condiciones. Cada curva corresponde a un pocillo de la microplaca. El software entrega el valor de la velocidad máxima (m) como Vmax para cada pocillo (círculo).
Otros métodos de recuento:
3.- Recuento directo: consiste en la observación al microscopio de volúmenes muy pequeños de suspensiones de bacterias. Se usan unos portaobjetos especiales denominados cámaras de Petroff-Hausser. Para que la medida sea correcta es necesario que la densidad de células sea del orden de 105 por ml.
4.- Medida del número de partículas usando contadores electrónicos de partículas. Estos sistemas no nos indican si las partículas corresponden a células vivas o muertas; pero nos pueden dar una idea del tamaño de las partículas.
El lector de microplaca Versamax® (Molecular Devices) con las siguientes características:
Longitud de onda: de 340 a 850 nm,
Temperatura controlada ( T ambiente + 4 a45ºC)
Linearidad fotométrica (405 nm): 0 a 3.0 DO
CounterCoulter: Permite rápidamente determinar el número de partículas presentes en una suspensión y la distribución de sus tamaños. No distingue entre células vivas y muertas ni entre células y agregados de material insoluble presente en la suspensión del cultivo.

Podes comprar el libro
MICRO, MACRO Y SUPER. Los organismos en Red.
con prólogo de Diego Golombek

Excelente articulo…
me gustaria una mayor informacion para poder citar el articulo segun normas APA en mi proyecto de pregrado.
Gracias!
Gracias por la hilo, te añadi a favoritos, adios